Mundo
Vida e morte de uma bactéria 'altruísta'
Os biofilmes, comunidades complexas de bactérias, abundam à nossa volta: na superfície do queijo onde libertam sabores e aromas, nos riachos onde formam a substância viscosa nas rochas, nos nossos dentes onde formam a placa bacteriana.
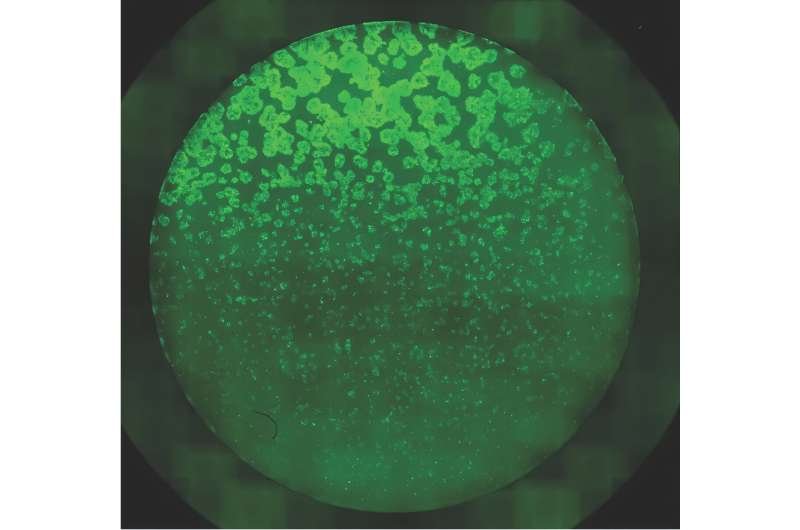
Imagem de fluorescência de um biofilme de Caulobacter. As células vivas são marcadas em verde, as mortas em rosa e a liberação de DNA extracelular durante a morte celular é mostrada em azul. Crédito: Cécile Berne, Université de Montréal
Os biofilmes, comunidades complexas de bactérias, abundam à nossa volta: na superfície do queijo onde libertam sabores e aromas, nos riachos onde formam a substância viscosa nas rochas, nos nossos dentes onde formam a placa bacteriana.
Viver em um biofilme oferece inúmeras vantagens para as bactérias: coisas como compartilhamento de recursos, abrigo de predadores e maior resistência a compostos tóxicos, como antibióticos.
Mas ter a opção de deixar o biofilme quando as condições ambientais se deterioram também pode ser uma vantagem para as bactérias, permitindo que elas se mudem para um ambiente mais hospitaleiro.
"Para a bactéria Caulobacter crescentus, o biofilme se torna uma espécie de prisão perpétua: uma vez que as células são fixadas a uma superfície por meio de um adesivo forte em uma das extremidades da célula, elas não podem sair do biofilme", ??disse Yves Brun, professor de Departamento de Microbiologia, Doenças Infecciosas e Imunologia da Université de Montréal.
''No entanto, quando essas células aderidas se dividem, suas células 'filhas' não aderidas têm a opção de se juntar ao biofilme ou nadar para longe.''
As células liberam seu DNA
Como as células decidem ficar ou sair do biofilme? “Mostramos em um estudo publicado em 2010 que quando as células Caulobacter morrem no biofilme, elas liberam seu DNA, o que inibe as células filhas de se juntarem ao biofilme, promovendo assim a realocação de ambientes onde a taxa de mortalidade aumenta”, disse Brun.
Ele e sua equipe de pesquisa, portanto, queriam determinar se a morte celular ocorria aleatoriamente à medida que a qualidade do ambiente diminuía ou se era um processo regulado respondendo a um sinal específico.
“Mostramos que Caulobacter usa um mecanismo de morte celular programada que faz com que algumas células se sacrifiquem quando as condições dentro do biofilme se deterioram”, disse Cécile Berne, principal autora do estudo, membro da equipe.
"Conhecido como um sistema toxina-antitoxina, este mecanismo usa uma toxina que visa uma função vital e seu antídoto associado, a antitoxina", disse ela. "A toxina é mais estável do que a antitoxina e quando a morte celular programada é iniciada, o quantidade de antitoxina é reduzida, resultando em morte celular .''
Quando o oxigênio se torna escasso
"Usando uma combinação de genética e microscopia, mostramos que o sistema toxina-antitoxina é ativado quando o oxigênio se torna escasso à medida que o biofilme se torna maior e as células competem pelo oxigênio disponível", acrescentou Berne.
A morte resultante de um subconjunto de células libera DNA, que promove a dispersão de seus irmãos vivos para ambientes potencialmente mais hospitaleiros, evitando assim a superlotação que reduziria ainda mais a qualidade ambiental do biofilme.
Os biofilmes têm impactos positivos e negativos em nossa vida cotidiana. Bactérias que vivem em biofilmes são comumente usadas na produção de alimentos, tratamento de águas residuais e remediação da poluição.
“A desvantagem é que o estilo de vida do biofilme também é uma estratégia usada pelas bactérias patogênicas para se tornarem mais resistentes aos antibióticos”, disse Brun.
"Entender os mecanismos que impulsionam o equilíbrio entre as células que se juntam ao biofilme e as células que nadam nos ajudará a desenvolver soluções para o desafio da resistência a antibióticos, para promover a formação de biofilmes quando queremos e erradicá-los quando não queremos."
" A dispersão celular estimulada por eDNA de biofilmes de Caulobacter crescentus mediante limitação de oxigênio depende de um sistema toxina-antitoxina " de Cécile Berne, Sébastien Zappa e Yves Brun foi publicado na eLife em 7 de dezembro de 2022.
Mais informações: Cecile Berne et al, dispersão celular estimulada por eDNA de biofilmes de Caulobacter crescentus após limitação de oxigênio depende de um sistema toxina-antitoxina, eLife (2022). DOI: 10.7554/eLife.80808
Informações do jornal: eLife