Mundo
Pesquisadores revelam mecanismo-chave por trás da reciclagem e organização celular
Um estudo recente publicado na eLife revelou um mecanismo crucial no gerenciamento de material celular: maturação do endossomo.
Modelo de trabalho ilustrando como USP-50/USP8 direciona a maturação do endossomo. Crédito: Laboratório do Dr. Ding Mei
Um estudo recente publicado na eLife revelou um mecanismo crucial no gerenciamento de material celular: maturação do endossomo. A equipe de pesquisa foi liderada pelo Dr. Ding Mei e pelo Dr. He Kangmin do Instituto de Genética e Biologia do Desenvolvimento da Academia Chinesa de Ciências.
Este processo é essencial para manter a saúde e a funcionalidade das células, permitindo a classificação, o transporte e a degradação de materiais dentro das células. Ele desempenha um papel fundamental na absorção de nutrientes, na defesa imunológica, na transmissão de sinais e na reciclagem de resíduos.
Os endossomos agem como "estações de triagem" dentro das células, processando substâncias como solutos, receptores, lipídios e patógenos. Os endossomos iniciais decidem quais materiais devem ser enviados de volta à superfície da célula para reutilização e quais devem ser degradados posteriormente.
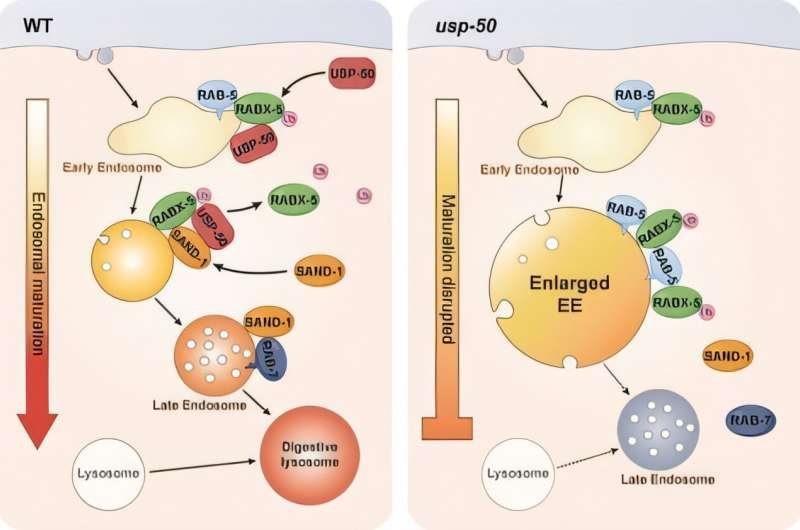
Materiais marcados para degradação são passados para endossomos tardios e, eventualmente, para lisossomos, onde são completamente quebrados. A transição de endossomos iniciais para endossomos tardios envolve uma "transferência" molecular, onde a proteína Rab5, marcando endossomos iniciais, é substituída por Rab7, marcando endossomos tardios.
No entanto, o mecanismo preciso por trás dessa mudança crítica permanece obscuro.
A equipe do Dr. Ding investigou o organismo modelo Caenorhabditis elegans e identificou um gene-chave, usp-50, que desempenha um papel vital na regulação da maturação do endossomo . Este gene codifica uma enzima deubiquitinante que remove as etiquetas de ubiquitina de proteínas específicas, contribuindo para a transição Rab5-para-Rab7.
Quando o gene usp-50 está ausente, os endossomos iniciais são anormalmente aumentados, os endossomos tardios são reduzidos em número e a formação do lisossomo digestivo é prejudicada, levando à interrupção do processamento do material celular.
Os pesquisadores descobriram ainda que esse mecanismo é refletido nas células humanas pela proteína USP8, que compartilha funções semelhantes com a USP-50.
O estudo mostrou que USP8 interage com Rabex5, um ativador Rab5, e remove as tags de ubiquitina dele. Essa etapa de dessubiquitinação faz com que Rabex5 se desprenda dos endossomos iniciais, abrindo caminho para proteínas como SAND-1/Mon1 ativarem Rab7, garantindo assim uma maturação suave do endossomo.
Essa descoberta não apenas esclarece o mecanismo molecular da maturação do endossomo, mas também tem implicações médicas significativas.
Anormalidades na função do USP8 foram associadas à síndrome de Cushing e a certos tipos de câncer, condições frequentemente caracterizadas por USP8 hiperativo ou disfuncional. Ao entender o papel do USP8 na maturação do endossomo, os cientistas esperam desenvolver terapias direcionadas para doenças relacionadas ao gerenciamento de material celular interrompido.
"Esta pesquisa aprofunda nossa compreensão da biologia celular e abre novos caminhos para o tratamento de doenças causadas por erros no gerenciamento de resíduos celulares", disse o Dr. Ding.
Mais informações: Yue Miao et al, Recrutamento espaço-temporal da protease USP8 específica da ubiquitina direciona a maturação do endossomo, eLife (2024). DOI: 10.7554/eLife.96353.4
Informações do periódico: eLife