Saúde
Pesquisadores podem ter resolvido mistério de décadas por trás dos efeitos colaterais dos benzodiazepínicos
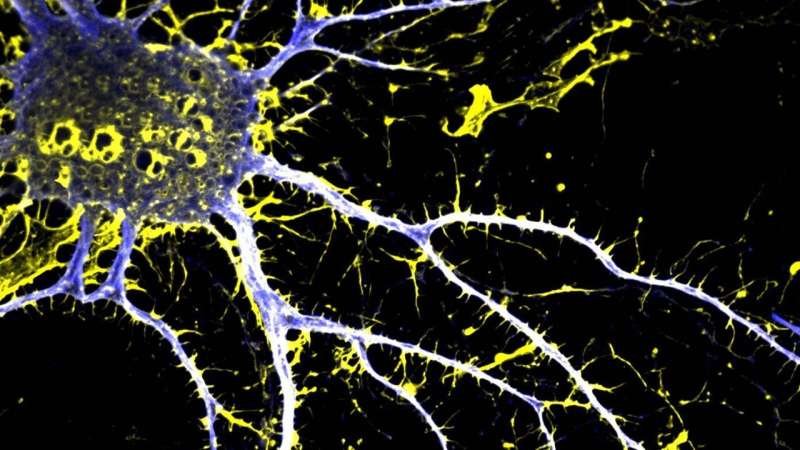
Benzodiazepínicos como Valium e Xanax são frequentemente prescritos para tratar ansiedade, insônia e convulsões. Embora esses medicamentos possam ser eficazes como tratamento de curto prazo, pesquisadores estão tentando...
Domínio público
Benzodiazepínicos como Valium e Xanax são frequentemente prescritos para tratar ansiedade, insônia e convulsões. Embora esses medicamentos possam ser eficazes como tratamento de curto prazo, pesquisadores estão tentando entender melhor o impacto dos benzodiazepínicos após uso prolongado.
Alguns especialistas acreditam que o uso prolongado do medicamento pode influenciar os níveis de inflamação em nossos corpos, já que pesquisas anteriores demonstraram que os benzodiazepínicos podem aumentar o risco de desenvolver ou agravar condições inflamatórias, como inflamação pulmonar e doença inflamatória intestinal . Durante anos, especialistas tentaram — sem muito sucesso — compreender melhor os mecanismos moleculares que podem estar causando esses efeitos colaterais.
Agora, uma equipe de pesquisa liderada pela Virginia Commonwealth University e pela Columbia University obteve novos insights sobre uma proteína suspeita de estar envolvida na inflamação relacionada aos benzodiazepínicos. Suas descobertas, publicadas no periódico The Proceedings of the National Academy of Sciences , podem subsidiar estratégias para aprimorar o desenvolvimento de medicamentos benzodiazepínicos, além de abrir novas oportunidades para o tratamento de condições relacionadas à inflamação, incluindo certos tipos de câncer, artrite, doença de Alzheimer e esclerose múltipla.
"Inúmeras tentativas foram feitas para determinar a estrutura e elucidar a função dessa misteriosa família de proteínas de membrana", disse Youzhong Guo, Ph.D., professor associado do Departamento de Química Medicinal da Faculdade de Farmácia da VCU e um dos principais pesquisadores do novo estudo. "Agora, após décadas de pesquisa, finalmente temos evidências promissoras que resolvem alguns dos mistérios em torno dessa proteína e podem ser cruciais para o avanço do design de medicamentos benzodiazepínicos."
Os benzodiazepínicos produzem seu efeito terapêutico ligando-se aos receptores GABA A no cérebro. No entanto, o medicamento tem uma afinidade igualmente forte com as proteínas sensoriais ricas em triptofano mitocondrial humano (HsTSPO1), localizadas na membrana externa das mitocôndrias das células. Esse tipo de proteína está associado a diversas doenças neurodegenerativas, incluindo o Alzheimer, e pesquisadores suspeitam que a HsTSPO1 possa estar envolvida em certos efeitos colaterais dos medicamentos benzodiazepínicos.
No entanto, tanto a estrutura quanto a função dessa família de proteínas têm sido debatidas na comunidade científica, inibindo os esforços para compreender seu papel em doenças e desenvolver terapias eficazes. Muitos cientistas teorizaram que a função potencial da HsTSPO1 é transportar colesterol através das membranas para regular a produção de hormônios esteroides.
Mas Guo e Wayne Hendrickson, Ph.D., professor do Departamento de Bioquímica e Biofísica Molecular do Vagelos College of Physicians and Surgeons da Universidade de Columbia e coautor do novo estudo, acreditam que é mais provável que o HsTSPO1 tenha uma função diferente.
"Proteínas sensoriais ricas em triptofano, como a HsTSPO1, são encontradas em todas as formas de vida, de bactérias e plantas a animais e humanos", disse Guo, que também atua no corpo docente de pesquisa do Centro de Descoberta de Fármacos da VCU. "Sabemos que esse tipo de proteína funciona como uma enzima em bactérias e, quando se considera a teoria da evolução, o mesmo tipo de proteína provavelmente também é uma enzima em humanos."
O interesse de Guo por essa área começou quando ele era pesquisador de pós-doutorado na Universidade Columbia, onde Hendrickson era seu orientador. Os dois têm trabalhado juntos desde então para tentar desvendar os mistérios por trás da estrutura e função dessa proteína.
A estrutura da HsTSPO1 permaneceu sem solução por muito tempo, em parte devido aos métodos utilizados para analisar proteínas de membrana. A membrana de células e organelas como as mitocôndrias é composta por uma bicamada lipídica, com proteínas aderidas ou incorporadas à estrutura. Pesquisadores utilizam detergentes para extrair e estabilizar essas proteínas. No entanto, o processo pode interferir nas interações proteína-lipídio, que frequentemente são essenciais para a estabilidade estrutural e a funcionalidade dessas proteínas.
Para superar esse desafio, Guo e seus colegas desenvolveram um método sem detergente, denominado sistema de nanopartículas de membrana celular nativa, que utiliza polímeros ativos na membrana para isolar e estabilizar proteínas da membrana , mantendo suas interações com os lipídios nativos. Usando essa tecnologia, os pesquisadores conseguiram estudar a HsTSPO1 em um estado que reflete mais de perto seu ambiente natural de membrana celular, revelando novos insights sobre a estrutura da proteína e suas interações com outros compostos.
"A instabilidade proteica causada por detergentes havia frustrado nossos esforços anteriores para caracterizar completamente sua estrutura e função", disse Guo. "No entanto, em nossa análise, descobrimos que a HsTSPO1 desempenhava sua função na presença de colesterol, demonstrando a importância de estudar essa proteína em um ambiente semelhante ao seu habitat natural. Semelhante a um peixe que você tira da água, ele ainda é um peixe, mas se comportará de maneira muito diferente."
Por meio desse método, a equipe de pesquisa encontrou evidências que sugerem que a HsTSPO1 funciona como uma enzima. Descobriram que a HsTSPO1 decompõe a protoporfirina IX, um composto encontrado em hemácias ricas em oxigênio, para criar um novo produto que os cientistas chamaram de bilindigina. Este produto ajuda a controlar o nível de "espécies reativas de oxigênio" (EROs) em nossos corpos, um tipo de composto que pode levar à inflamação e matar células se não for regulado.
Essa descoberta sugere que, quando o valium e outros benzodiazepínicos se ligam à HsTSPO1, inibem a capacidade da proteína de controlar os níveis de ROS em nossas células. Isso pode ajudar a explicar por que esses medicamentos causam efeitos colaterais ao longo do tempo, embora mais pesquisas sejam necessárias para compreender completamente se esses mecanismos moleculares desempenham um papel na geração de efeitos colaterais adversos.
"A atividade enzimática que encontramos para o HsTSPO1 reduz tanto a produção quanto a neutralização de ROS", disse Hendrickson. "Essa descoberta fornece uma justificativa para novas abordagens na descoberta de fármacos."
Os novos insights sobre a função da HsTSPO1 podem ajudar as empresas farmacêuticas a desenvolver benzodiazepínicos aprimorados. Além disso, devido ao seu papel recém-descoberto na regulação de espécies reativas de oxigênio, os pesquisadores afirmam que a HsTSPO1 pode servir como um alvo promissor para o monitoramento e tratamento de doenças neurodegenerativas, como Alzheimer, bem como outras condições relacionadas à inflamação que têm conexões com a HsTSPO1. Isso inclui alguns tipos de câncer, artrite e esclerose múltipla.
"Os benzodiazepínicos ainda são amplamente utilizados para tratar ansiedade, insônia, convulsões e outras condições. Agora que entendemos como a HsTSPO1 funciona, podemos potencialmente criar medicamentos melhores com menos efeitos colaterais", disse Guo. "Mas, em uma escala maior, nossos conhecimentos sobre essa proteína podem ter implicações significativas para o desenvolvimento de novas opções terapêuticas para pacientes afetados por doenças inflamatórias."
Mais informações: Weihua Qiu et al., Atividade enzimática dependente de colesterol da TSPO1 humana, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2323045122
Informações do periódico: Proceedings of the National Academy of Sciences
Fornecido pela Virginia Commonwealth University