Saúde
Proteana de pico Sars-CoV-2 ativa retrovarus enda³genos humanos nas células do sangue
Os retrotransposons derivam de retrovarus enda³genos humanos (HERVs), mas normalmente perderam suas sequaªncias de repetia§a£o terminais longas de assinatura no inicio e no final de seus genes.
Crédito: Wikipanãdia
Elementos transponaveis, ou genes saltadores, são agora conhecidos por serem responsa¡veis ​​por muitas doenças humanas. Mantaª-los reprimidos por metilação, ligação de RNA ou as atenções do sistema imunológico inato éum salto em tempo integral para as células.
Na semana passada, revisamos a ativação de um tipo particular de elemento transponavel, os retrotransposons Line-1 , em uma sanãrie de condições neurodegenerativas em constante expansão. Os retrotransposons derivam de retrovarus enda³genos humanos (HERVs), mas normalmente perderam suas sequaªncias de repetição terminais longas de assinatura no inicio e no final de seus genes.
Na tera§a-feira, um alerta real foi lana§ado no servidor de pré-impressão medRxiv que poderia explicar muitas das caracteristicas patogaªnicas comumente observadas do SARS-CoV-2. Os autores fornecem evidaªncias sãolidas de que a proteana spike SARS-CoV-2 ativa a proteana do envelope (ENV) codificada por HERV-W nas células sanguíneas , que por sua vez édiretamente responsável por muitas caracteristicas patola³gicas da doena§a. HERV-W énomeado pelo fato de que muitos retrovarus no grupo usam um tRNA de triptofano no satio de ligação do primer. Aparentemente, a forma da letra W de alguma forma lembrou o comitaª de nomeação da forma da estrutura do anel dos a¡tomos na cadeia lateral do triptofano.
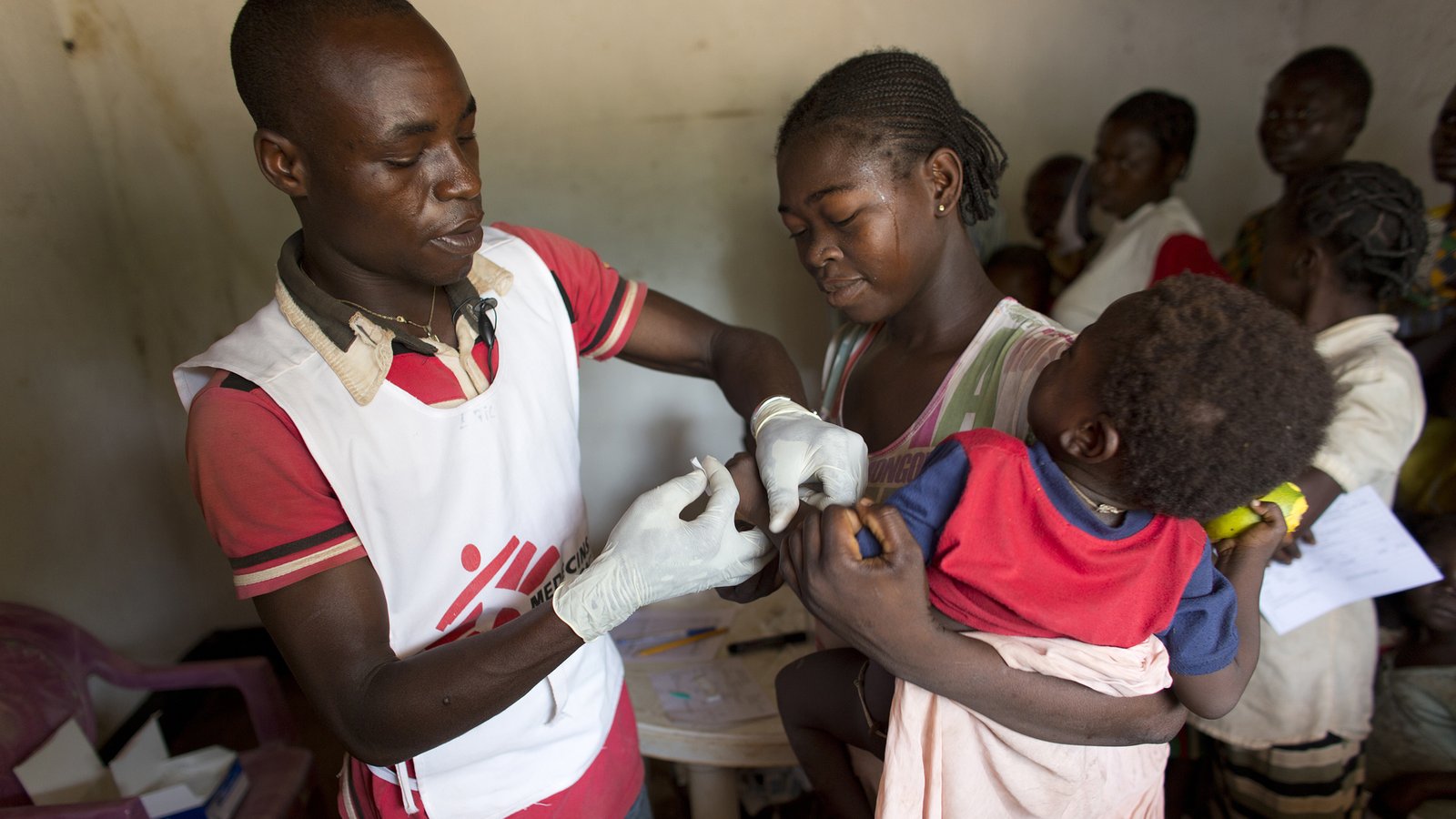
Os pesquisadores já haviam observado uma correlação na expressão da proteana HERV-W ENV em linfa³citos T com desconforto respirata³rio grave em pacientes com SARS-CoV-2. No entanto, os mecanismos exatos envolvidos não eram claros. Agora, o verdadeiro culpado na ativação do HERV-W foi descoberto. Os pesquisadores adicionaram uma proteana de pico trimanãrico recombinante sem mutações estabilizadoras a células mononucleares de sangue perifanãrico (PBMCs) cultivadas de pacientes com SARS-CoV-2. Eles encontraram upregulation imediato e significativo dos RNAs para a proteana ENV de HERV-W e HERV-K. Curiosamente, apenas os RNAs para HERV-W resultaram na expressão subsequente da proteana ENV.
As proteanas spike nativas tendem a se redobrar prematuramente em uma conformação pa³s-fusão, o que compromete as propriedades imunogaªnicas e os rendimentos de trameros de pré-fusão. As vacinas de mRNA, portanto, tem pequenas modificações que simultaneamente tornam o mRNA menos imunogaªnico, e a proteana spike que ele codifica mais imunogaªnica. Uma maneira de fazer isso éestabilizar os conformes específicos por meio da adição de duas prolinas estratanãgicas ao ca³digo. No entanto, mais pesquisas são necessa¡rias para caracterizar completamente o potencial fusogaªnico de proteanas de pico estabilizadas. Alguns fabricantes de vacinas eliminaram o local de clivagem da furina de sua construção de mRNA para reduzir a fusão residual potencial de uma construção estabilizada com 2-PP. Algumas dessas observações foram inicialmente apontadas para mim por um pesquisador ana´nimo nas madias sociais operando com o apelido de "dama da corte subterra¢nea".
Â
Uma descoberta importante nesses estudos éque nem todos os pacientes com COVID tiveram ativação significativa do HERV-W ENV; apenas 20 ou 30 por cento deles o fizeram. Essa descoberta provavelmente reflete uma suscetibilidade genanãtica subjacente entre os infectados que absolutamente precisa ser definida e levada em consideração, principalmente se o HERV-W for usado como marcador geral da gravidade da doença ou como alvo terapaªutico para um anticorpo monoclonal humanizado terapia, como agora se imagina. Por exemplo, a ativação de uma forma hexamanãrica solaºvel de HERV-W foi encontrada na esclerose maºltipla e estãomarcada como opção potencialmente drogavel.
Mas qual HERV-W, exatamente? Mais de 1% de nossos genomas são remanescentes de HERV-W, mais do que todas as nossas regiaµes codificadoras de proteanas juntas. De fato, existem pelo menos 13 loci HERV-W com genes ENV completos no genoma humano. Um deles, que vem da regia£o cromossa´mica 7q21.2, tem um quadro de leitura aberto ininterrupto para uma proteana HERV-W ENV completa. Esta proteana, Sincitina-1, figura famosa e essencialmente no desenvolvimento normal da placenta. Para complicar as coisas, a MS agora parece ter muitas origens potenciais eclanãticas. Pesquisadores revelaram esta semana, com aclamação considera¡vel , que a infecção pelo varus Epstein-Barr éum importante gatilho a montante, ou a jusante, ou talvez totalmente independente para a EM.
HERV-W não éo aºnico jogo retroviral na cidade. Pesquisadores descobriram recentemente que uma proteana semelhante a retrovarus conhecida como PEG10 se liga diretamente e secreta seu pra³prio mRNA em capsadeos extracelulares semelhantes a varus. Esse comportamento éestranhamente semelhante ao da proteana retroviral ARC1, agora entendida como cratica na formação da memória em locais sina¡pticos. Incrivelmente, os pesquisadores já estãoa caminho de pseudotipar essaspartículas semelhantes a varus com fusogens para criar um vetor enda³geno para fornecer cargas de mRNA funcionais como terapia genanãtica. Claramente, alguma cautela nestes assuntos éjustificada (aviso: opinia£o).
Em amostras de tecido cardaaco de pacientes com COVID-19, o HERV-W ENV foi encontrado principalmente em células endoteliaisde numerosos pequenos vasos sanguaneos e no tecido adiposo perica¡rdico. A natureza endotelial das células positivas para HERV-W ENV foi confirmada neste caso com coloração de CD31. De forma ameaa§adora, foi encontrado ENV HERV-W significativo em pacientes em coa¡gulos sanguaneos, mucosa nasal e também no sistema nervoso central, particularmente em células microgliais, mesmo quando o SARS-CoV-2 não pa´de ser detectado nesses tecidos. Os autores observam que o SARS-CoV-2 induziu a expressão de HERV-W ENV em células linfoides humanas, células que não expressam o receptor ACE2 cana´nico nem a protease TMPRSS2. Isso sugere outras rotas para o varus nessas células. Uma pista recente para outros mecanismos candidatos pode vir de receptores alternativos como o ASGR1, que éaltamente expresso nas células do fígado .
Agora éde extrema importa¢ncia descobrir como o SARS-CoV-2 ativa os HERVs. Aluz da tendaªncia conhecida de elementos transponaveis para serem ativados e integrados em locais de reparo de DNA ativo, pode valer a pena revisitar estudos anteriores que pretendiam mostrar que o RNA de SARS-CoV-2 transcrito reverso poderia se integrar ao genoma de células humanas cultivadase subsequentemente expresso em tecidos derivados do paciente. Esses autores encontraram duplicações de satio alvo flanqueando as sequaªncias virais e sequaªncias de reconhecimento de endonuclease LINE1 de consenso nos satios de integração - caracteristicas consistentes com um mecanismo de retroposição e transcrição reversa LINE1 mediado por retrotransposon e iniciado por alvo.