Tecnologia Científica
Técnica de expansão para imagens de estruturas em nanoescala dentro de células torna imagens de alta resolução mais acessíveis
Uma maneira clássica de obter imagens de estruturas em nanoescala em células é com microscópios de super-resolução caros e de alta potência. Como alternativa, pesquisadores do MIT desenvolveram uma maneira de expandir o tecido antes...
Crédito: Tima Miroshnichenko de Pexels
Uma maneira clássica de obter imagens de estruturas em nanoescala em células é com microscópios de super-resolução caros e de alta potência. Como alternativa, pesquisadores do MIT desenvolveram uma maneira de expandir o tecido antes de obter imagens dele — uma técnica que permite que eles alcancem resolução em nanoescala com um microscópio de luz convencional.
Na versão mais recente dessa técnica, os pesquisadores tornaram possível expandir o tecido 20 vezes em uma única etapa. Esse método simples e barato pode abrir caminho para que quase qualquer laboratório de biologia realize imagens em nanoescala.
"Isso democratiza a geração de imagens", diz Laura Kiessling, professora de Química da Novartis no MIT e membro do Broad Institute do MIT e Harvard e do Koch Institute for Integrative Cancer Research do MIT.
"Sem esse método, se você quiser ver coisas com alta resolução, você tem que usar microscópios muito caros. O que essa nova técnica permite que você faça é ver coisas que você normalmente não conseguiria ver com microscópios padrão. Ela reduz o custo da imagem porque você pode ver coisas em nanoescala sem a necessidade de uma instalação especializada."
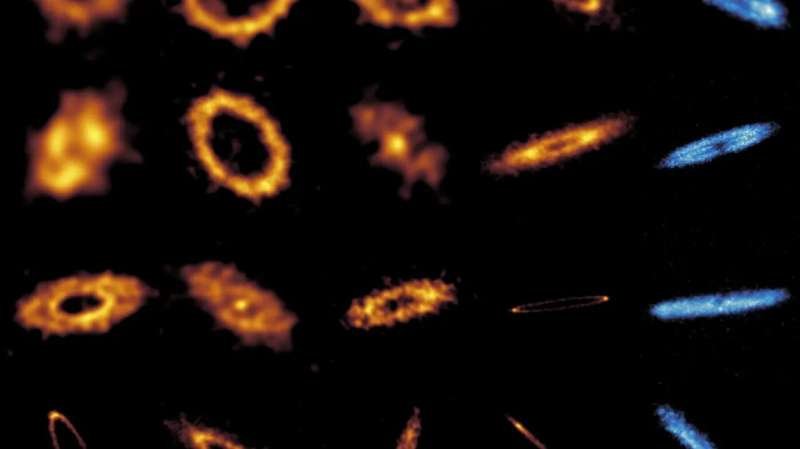
Na resolução alcançada por essa técnica, que é de cerca de 20 nanômetros, os cientistas conseguem ver organelas dentro das células, bem como aglomerados de proteínas.
"A expansão de vinte vezes leva você ao reino em que as moléculas biológicas operam. Os blocos de construção da vida são coisas em nanoescala: biomoléculas, genes e produtos genéticos ", diz Edward Boyden, professor Y. Eva Tan em Neurotecnologia no MIT; professor de engenharia biológica, artes e ciências da mídia e ciências cognitivas e do cérebro; pesquisador do Instituto Médico Howard Hughes; e membro do Instituto McGovern de Pesquisa do Cérebro e do Instituto Koch de Pesquisa Integrativa do Câncer do MIT.
Boyden e Kiessling são os autores principais do novo estudo, publicado na Nature Methods . O estudante de pós-graduação do MIT Shiwei Wang e Tay Won Shin Ph.D. são os principais autores do artigo.
Uma única expansão
O laboratório de Boyden inventou a microscopia de expansão em 2015. A técnica requer a incorporação de tecido em um polímero absorvente e a quebra das proteínas que normalmente mantêm o tecido unido. Quando a água é adicionada, o gel incha e separa as biomoléculas umas das outras.
A versão original dessa técnica, que expandiu o tecido cerca de quatro vezes, permitiu que os pesquisadores obtivessem imagens com uma resolução de cerca de 70 nanômetros. Em 2017, o laboratório de Boyden modificou o processo para incluir uma segunda etapa de expansão, alcançando uma expansão geral de 20 vezes. Isso permite uma resolução ainda maior, mas o processo é mais complicado.
"Nós desenvolvemos várias tecnologias de expansão de 20 vezes no passado, mas elas exigem múltiplas etapas de expansão", diz Boyden. "Se você pudesse fazer essa quantidade de expansão em uma única etapa, isso poderia simplificar as coisas um pouco."
Com expansão de 20 vezes, os pesquisadores podem chegar a uma resolução de cerca de 20 nanômetros, usando um microscópio de luz convencional. Isso permite que eles vejam estruturas celulares como microtúbulos e mitocôndrias, bem como aglomerados de proteínas.
No novo estudo, os pesquisadores se propuseram a realizar uma expansão de 20 vezes com apenas uma etapa. Isso significava que eles tinham que encontrar um gel que fosse extremamente absorvente e mecanicamente estável, para que ele não se desfizesse quando expandido 20 vezes.
Para conseguir isso, eles usaram um gel montado a partir de N,N-dimetilacrilamida (DMAA) e acrilato de sódio. Diferentemente dos géis de expansão anteriores que dependem da adição de outra molécula para formar ligações cruzadas entre os filamentos de polímero, este gel forma ligações cruzadas espontaneamente e exibe fortes propriedades mecânicas.
Tais componentes de gel já haviam sido usados em protocolos de microscopia de expansão , mas os géis resultantes podiam se expandir apenas cerca de dez vezes. A equipe do MIT otimizou o gel e o processo de polimerização para torná-lo mais robusto e permitir uma expansão de 20 vezes.
Para estabilizar ainda mais o gel e aumentar sua reprodutibilidade, os pesquisadores removeram o oxigênio da solução do polímero antes da gelificação, o que previne reações colaterais que interferem na reticulação. Esta etapa requer a passagem de gás nitrogênio pela solução do polímero, que substitui a maior parte do oxigênio no sistema.
Uma vez que o gel é formado, ligações selecionadas nas proteínas que mantêm o tecido unido são quebradas e água é adicionada para fazer o gel se expandir. Após a expansão ser realizada, proteínas alvo no tecido podem ser rotuladas e imageadas.
"Essa abordagem pode exigir mais preparação de amostra em comparação a outras técnicas de super-resolução, mas é muito mais simples quando se trata do processo de imagem real, especialmente para imagens 3D", diz Shin. "Documentamos o protocolo passo a passo no manuscrito para que os leitores possam passar por ele facilmente."
Imaginando estruturas minúsculas
Usando essa técnica, os pesquisadores conseguiram obter imagens de muitas estruturas minúsculas dentro das células cerebrais, incluindo estruturas chamadas nanocolunas sinápticas. Esses são aglomerados de proteínas que são arranjados de uma maneira específica nas sinapses neuronais, permitindo que os neurônios se comuniquem entre si por meio da secreção de neurotransmissores como a dopamina.
Em estudos de células cancerígenas, os pesquisadores também fizeram imagens de microtúbulos — tubos ocos que ajudam a dar às células sua estrutura e desempenham papéis importantes na divisão celular. Eles também conseguiram ver mitocôndrias (organelas que geram energia) e até mesmo a organização de complexos de poros nucleares individuais (agrupamentos de proteínas que controlam o acesso ao núcleo da célula).
Wang agora está usando essa técnica para obter imagens de carboidratos conhecidos como glicanos, que são encontrados em superfícies celulares e ajudam a controlar as interações das células com seu ambiente. Esse método também pode ser usado para obter imagens de células tumorais, permitindo que os cientistas vislumbrem como as proteínas são organizadas dentro dessas células, muito mais facilmente do que era possível anteriormente.
Os pesquisadores preveem que qualquer laboratório de biologia deve ser capaz de usar essa técnica a um custo baixo, já que ela depende de produtos químicos padrão e prontos para uso e equipamentos comuns, como microscópios confocais e bolsas de luvas, que a maioria dos laboratórios já possui ou pode acessar facilmente.
"Nossa esperança é que, com essa nova tecnologia, qualquer laboratório de biologia convencional possa usar esse protocolo com seus microscópios existentes, permitindo que eles se aproximem de uma resolução que só pode ser alcançada com microscópios de última geração, muito especializados e caros", diz Wang.
Mais informações: Microscopia de expansão de 20 vezes de disparo único, Nature Methods (2024). DOI: 10.1038/s41592-024-02454-9
Informações do periódico: Nature Methods