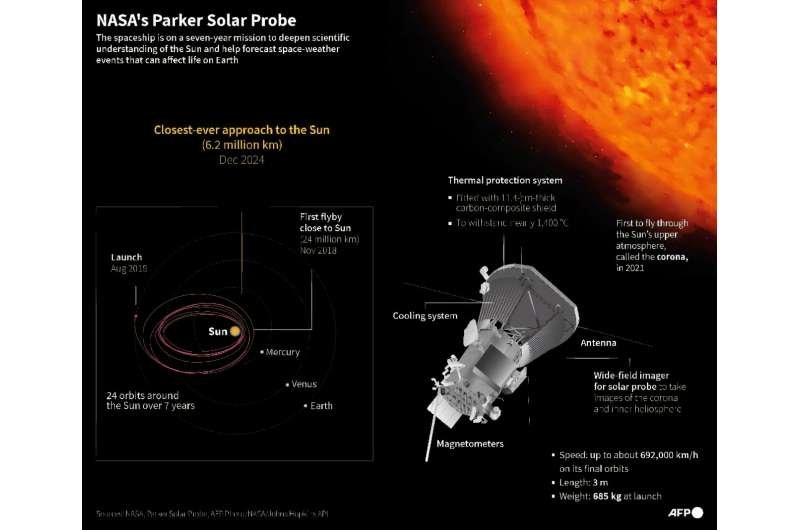
Tecnologia Científica
Cientistas desenvolvem transporte autossustentável de proteínas e montagem de tecidos em células artificiais
Em um novo estudo da Nature Communications , cientistas desenvolveram um novo método para células artificiais interagirem com seu ambiente externo sem a necessidade de processos complexos de modificação.
Esquema da funcionalização da membrana autocodificada. 1: -hemolisina é expressa dentro de células artificiais como um monômero. 2: Oligomerização e inserção de membrana permitem a translocação de peptídeos para a membrana externa. 3: Anticorpo fluorescente (roxo) pode ligar peptídeos na membrana externa. ?HL (verde) é ligado à membrana interna. Crédito: Neal K. Devaraj.
Em um novo estudo da Nature Communications , cientistas desenvolveram um novo método para células artificiais interagirem com seu ambiente externo sem a necessidade de processos complexos de modificação.
Este método pode abrir novas fronteiras em engenharia de tecidos , administração de medicamentos e processos celulares.
As células biológicas são protegidas por uma membrana, feita de fosfolipídios, que modula as interações com o ambiente externo. Recriar isso em células artificiais é desafiador, exigindo modificação externa manual da membrana.
Isto é particularmente verdadeiro para a translocação ou movimento de proteínas através da membrana. O presente estudo aborda este problema desenvolvendo um método no qual células artificiais modificam sua própria membrana.
Falando sobre a motivação da equipe para desenvolver este novo método, o Prof. Devaraj disse: "A reconstituição de proteínas de membrana em sistemas artificiais tem sido um problema de longa data na pesquisa com células artificiais.
"Proteínas de membrana são frequentemente insolúveis em água, o que as torna difíceis de trabalhar. Células naturais têm sistemas complexos que garantem que essas proteínas possam ser inseridas eficientemente em membranas celulares."
Harjung acrescentou: "Para células artificiais, seria muito desafiador reconstituir esses sistemas de inserção de membrana, e é por isso que vimos a necessidade de desenvolver um sistema muito mais simples para que células artificiais ganhem a capacidade de funcionalizar sua própria membrana celular."
Para o estudo, os pesquisadores tiveram como objetivo funcionalizar a membrana celular para permitir o transporte de proteínas através da membrana e montá-las em estruturas semelhantes a tecidos posteriormente.
Trabalhando com -hemolisina
Os canais biológicos normalmente usam canais iônicos e transportadores para trocar substâncias através da membrana. Em células artificiais, essa interação tem que ser replicada manualmente.
O professor Devaraj explicou: "O pesquisador pode alterar a composição da membrana para conseguir isso, o que é muito diferente de como as células naturais interagem com seu ambiente.
"Para superar esse problema, desenvolvemos um método com o qual é possível codificar a modificação da membrana externa e, assim, interagir com o ambiente externo, no genoma da célula artificial."
Para fazer isso, os pesquisadores escolheram uma proteína formadora de poros chamada -hemolisina. Esta é uma proteína produzida pelo Staphylococcus aureus, a bactéria responsável por causar infecções por estafilococos. Ela é tecnicamente denominada toxina, pois forma buracos nas membranas celulares.
Explicando o raciocínio por trás da escolha dessa proteína, Harjung disse: "Muitos pesquisadores já estão familiarizados com ela devido ao seu amplo uso em células artificiais e sequenciamento de nanoporos.
"Ele tem a capacidade única de ser expresso como um monômero solúvel que, ao entrar em contato com uma bicamada lipídica (membrana celular), se reúne espontaneamente em uma proteína transmembrana."
Os pesquisadores não só usaram a -Hemolysin como uma proteína formadora de poros, mas também modificaram as células artificiais para produzir a proteína elas mesmas. Por ter um sistema autossustentável, os pesquisadores não precisam adicionar a proteína toda vez.
Inserindo peptídeos e produzindo mutações de -hemolisina
Para melhorar a funcionalidade da -hemolisina e obter melhor controle do processo de formação de poros, os pesquisadores decidiram modificá-la.
Em particular, seu foco era modificar o loop de translocação da membrana da proteína, que é a parte da proteína que desempenha um papel na translocação.
Eles testaram peptídeos de diferentes comprimentos e composições. Peptídeos são cadeias curtas de aminoácidos, que são os blocos de construção das proteínas. Eles usaram linkers flexíveis, cadeias curtas de aminoácidos, que agem como pontes para facilitar a interação ou o movimento entre diferentes partes da proteína.
Esta etapa melhora a acessibilidade do peptídeo quando a proteína é incorporada na membrana celular.
"O linker flexível garante que o peptídeo inserido seja acessível após a translocação através da membrana. Ao variar o comprimento do linker, conseguimos entender mais sobre o tamanho do inserto peptídico que poderia ser translocado com nosso sistema", explicou o Prof. Devaraj.
Os pesquisadores testaram vários peptídeos. Peptídeos his-tag — sequências curtas de aminoácidos histidina — foram usados ??para rastrear o movimento da -hemolisina enquanto ela viaja e se incorpora à membrana celular.
Em seguida, os pesquisadores usaram dois peptídeos biologicamente ativos, Somatostatina-14 e GLP-1, como inserções na -hemolisina para testar a translocação.
Para validar suas descobertas, os pesquisadores usaram vários métodos, incluindo ensaio de ligação e vazamento de GUV para testar interações peptídeo-membrana, microscopia crioeletrônica para examinar a estrutura da proteína, gravações de canais de bicamada lipídica para avaliar a formação de poros e experimentos de reconhecimento de anticorpos para confirmar a translocação do peptídeo.
Translocação de proteína bem-sucedida
A -hemolisina modificada viajou com sucesso para a membrana celular e se incorporou. Após isso, os insertos peptídicos puderam translocar-se com sucesso através da membrana, demonstrando transporte de proteína.
Peptídeos contendo até 50 aminoácidos podem ser inseridos na -hemolisina sem interromper a formação de poros, a inserção da membrana e a funcionalidade da proteína.
Os pesquisadores descobriram ainda que os peptídeos translocados permaneceram acessíveis no lado externo da membrana. Isso sugere que eles poderiam ser usados para montar estruturas semelhantes a tecidos, pois sua acessibilidade permite mais interações e organização no ambiente externo.
Harjung explicou isso, dizendo: "O sistema permite a montagem de estruturas semelhantes a tecidos com base em interações eletrostáticas.
"Ao gerar uma população de células artificiais que translocam peptídeos carregados negativamente através de sua membrana e outra população de células artificiais que translocam peptídeos carregados positivamente, podemos criar uma estrutura semelhante a um tecido, porque células artificiais com uma membrana externa carregada negativamente se ligarão a células artificiais com uma membrana carregada positivamente."
Administração de medicamentos e tecidos artificiais
Os pesquisadores também adicionaram um sistema para detectar se as células podem se comunicar entre si, onde as células produzem um sinal visível (fluorescente) quando recebem um sinal de outras células. Isso pode ajudar na criação de tecidos artificiais mais complexos e funcionais para aplicações futuras.
Com a possibilidade de desenvolver tecidos artificiais e potenciais sistemas de administração de medicamentos, o novo método demonstra um passo fundamental na pesquisa celular.
"Com o desenvolvimento dos produtos biológicos, os métodos para a entrega eficiente de macromoléculas biológicas em células vivas têm importância crescente na medicina", mencionou o Prof. Devaraj.
Harjung acrescentou: "Uma melhor compreensão da translocação de membrana pode levar ao desenvolvimento de ferramentas para a administração de terapêuticas macromoleculares através de membranas lipídicas e para dentro de células vivas."
Mais informações: Alexander Harjung et al, Codificação de modificação extracelular de membranas celulares artificiais usando proteínas autotranslocáveis projetadas, Nature Communications (2024). DOI: 10.1038/s41467-024-53783-4 , www.nature.com/articles/s41467-024-53783-4
Informações do periódico: Nature Communications